译者:旌旗三角屋(丢勒)
译者前言:我翻译这篇文章是因为作者们善良的开放了转载权限,虽然他们的研究没啥惊天动地的结果,但是他们的引用非常全面。如果你有意探究DID患者大脑的变化,可以试着直接搜索本文的引用信息,基本涵盖了所有DID脑科学的前沿信息。(本人非生物学出身的专有词汇可能有误,统计学过一些应该没问题)
原标题:Normal amygdala morphology in dissociative identity disorder,在2022年 3 月 15 日由剑桥大学出版社代表皇家精神病学家学院出版。
摘要:
调查杏仁核结构与解离相关性的研究非常有限,这些研究报告的杏仁核整体体积有的正常或不变,有的增大或减小。因此,有必要对杏仁核进行更详细的研究。
我们比较了分离性身份识别障碍患者(DID:n = 32)和健康对照组(n = 42)的杏仁核总体和亚区域体积。协方差分析并未显示分离性身份识别障碍组和对照组的体积差异。虽然有几个未知因素使得阐释研究成果具有挑战性,但我们认为杏仁核体积正常是一个真实结论,因为使用该数据集的其他研究也显示了与 DID 诊断相关的强大形态学畸变。
正文:
海马体和杏仁核是最早被研究分离性遗忘症(包括分离性身份识别障碍(DID))的神经结构区域。Roydeva 和 Reinders1 在最近的一篇系统综述中提出,海马体积缩小是DID患者分离性遗忘的神经结构生物标志物。后来的一项研究(参考Dimitrova、Dean、Schlumpf.Vissia、 Nijienhuis和Chatzi2)证实了这一观点,并明确指出双侧海马体积变小可能是由海马亚区(即双侧CA1、右侧CA4、齿状回右侧颗粒细胞分子层和左侧前丘脑)体积变小引起的。研究进一步提出,双侧CA1亚区体积的减少是DID患者分离性遗忘的生物标志物。
Roydeva和Reinders1的说法是:对DID和其他涉及解离障碍的杏仁核结构进行的研究较为有限,且不太一致。与解离有关的杏仁核灰质体积被发现正常或异常,Chalavi, Vissia, Giesen, Nijenhuis, Draijer #D Barker3, 5# Nicholson, Aybek, Kempton、Daly、Murphy 和 David4 的实验结果是杏仁核体积会增加或减少;Roydeva 和Reinders1的研究结果是 DID 患者杏仁核总体体积正常,可能是因为参与研究的人数较少导致研究结果无法达到统计学意义,也可能是因为他们将子区体积的增减变量混合添加到正常杏仁核体积的净发现中。
Spiegel、Lewis-Fernández、Lanius、Vermetten、Simeon 和 Friedman5 对创伤后应激障碍(PTSD)(一种与 DID 密切相关的疾病)的研究发现,杏仁核亚区体积增加和减少并存。Morey、Clarke、Haswell、Phillips、Clausen 和 Mufford6 表明研究解离中的杏仁核是非常重要的,因为杏仁核在解离的神经功能生物模型中被赋予了关键的作用,其中假设解离涉及中线前额叶区域对杏仁核的情绪调节过度。 (参考 Lanius、Vermetten、Loewenstein、Brand、Christian 和 Bremner7,参考 Reinders、Willemsen、den Boer、Vos、Veltman 和 Loewenstein8)。
在本次实验我们调查了 DID 患者的杏仁核体积,目的有两个。第一是探讨,我们之前发现”这种疾病患者的杏仁核体积正常“可能是由于统计学能力较低所致(参考文献:Chalavi, Vissia, Giesen, Nijenhuis, Draijer and Barker3)。为此,我们将样本量增加了一倍。第二个目的是同时研究杏仁核的总体体积和亚区体积,以研究亚区体积的增加和减少是否会导致总体体积正常的净结果。
实验方法
参与者:
共收集了 75 名女性(只有患有 DID 的女性参与者自愿参加)的数据。其中包括 32 名患有 DID 的女性志愿者和 43 名在年龄、性别、受教育年限和种族方面匹配的健康对照者。
数据在荷兰格罗宁根大学医学中心(UMCG)和阿姆斯特丹医学中心(AMC)以及瑞士苏黎世大学医院(UHZ)收集。( 参考资料:Dimitrova、Dean、Schlumpf、Vissia、Nijenhuis 和 Chatzi2;参考资料:Reinders、Chalavi、Schlumpf、Vissia、Nijenhuis 和 Jäncke9;参考资料:Reinders、Marquand、Schlumpf、Chalavi、Vissia 和 Nijenhuis10 )。
所有参与者均按照《赫尔辛基宣言》以及 UMCG(参考编号:METC2008. 211)和 AMC(编号:MEC09/155)以及苏黎世州伦理委员会(Kantonale Ethikkommission Zürich;编号:E-13/2008)的伦理要求。根据《赫尔辛基宣言》的伦理要求,所有参与者均有权退出,并接受了全面的情况汇报。本研究的参与者和数据与有关海马作为解离神经结构生物标志物的研究(参考 Dimitrova、Dean、Schlumpf、Vissia、Nijenhuis 和 Chatzi2)和全脑形态学研究相同。 (参考资料 Reinders、Chalavi、Schlumpf、Vissia、Nijenhuis 和 Jäncke9,参考资料 Reinders、Marquand、Schlumpf、Chalavi、Vissia 和 Nijenhuis10)。
总之,DID 参与者是由训练有素的临床医生使用 DSM-IV 解离障碍结构化临床访谈(SCID-D)诊断出来的,所有参与者都合并有创伤后应激障碍或创伤后应激障碍缓解期诊断,以及参与者及其个人治疗师确认的其他合并症。( 参考资料:Reinders、Chalavi、Schlumpf、Vissia、Nijenhuis 和 Jäncke9,参考资料:Reinders、Marquand、Schlumpf、Chalavi、Vissia 和 Nijenhuis10),对照组通过当地报纸广告招募。
所有参与者的排除标准包括年龄在 18-65 岁范围之外、怀孕、系统性或神经性疾病、幽闭恐惧症、体内植入金属和药物滥用。对照组的其他排除标准包括存在分离症状和创伤史、过去或现在患有精神疾病以及服用药物。对照组的参与者必须没有或仅有有限的(躯体形式)分离症状和潜在的创伤经历。
数据采集:
磁共振成像(MRI)数据使用来自荷兰(AMC和UMCG)和瑞士(UHZ)中心的3t飞利浦全身扫描仪(飞利浦医疗系统,Best,荷兰)收集。采用优化的三个参与中心的t1加权解剖MRI方案:参考Chalavi, Simmons, Dijkstra, Barker和Reinders11三维磁性制备快速梯度回波成像(3-D MP-RAGE),重复时间TR = 9.95 ms,回波时间TE = 5.6 ms,翻转角度8°,体元大小1 × 1 × 1 mm3,切片数160,总扫描时间10 min 14 s。DID与对照受试者的比例在各中心之间大致相等,每组受试者的人数在各中心之间没有差异(χ2 = 1.01, P = 0.603)。
容积分析:
MRI数据使用FreeSurfer 7.0 for MacOS处理(http://surfer.nmr.mgh.harvard.edu)。这个版本允许提取杏仁核的整体和亚区域。在进行全面重建和体积分割后,提取整个杏仁核、外侧核、基底核、副基底核、杏仁核前部区、中央核、内侧核、皮质核、皮质杏仁核过渡区和各半球的体积测量值。计算总颅间容积(TIV)。有关方法的全部细节已在其他地方公布。(参考fisch12)对于来自对照组的一名参与者,FreeSurfer无法完成杏仁核分割。因此,该参与者被排除在后续的统计分析之外。
统计分析:
所有分析均使用 SPSS 26 版(http://www.ibm.com/uk-en/products/spss-statistics)进行。每个半球杏仁核体积的组间差异通过协方差分析(ANCOVA)进行检验。杏仁核体积为因变量,组别和中心为固定分类效应,年龄和估计 TIV 为连续协变量。通过比较主效应的估计边际平均值,并对所有亚区和总体积进行帮费罗尼法(Bonferroni)检验后校正,研究了组间差异。
实验结果:
图表 1 显示了杏仁核总体容量和杏仁核亚区容量的描述性统计和组间分析(协方差分析 (ANCOVA))结果。我们没有发现 DID 组和对照组在杏仁核整体体积或杏仁核亚区体积方面存在任何明显差异。只有一个趋势表明,DID 组的杏仁核体积有所减少,那就是左侧皮质杏仁核过渡区(F(1,66) = 3.839, P = 0.054, ηp2 = 0.55),平均减少了 9.090 mm3次方。
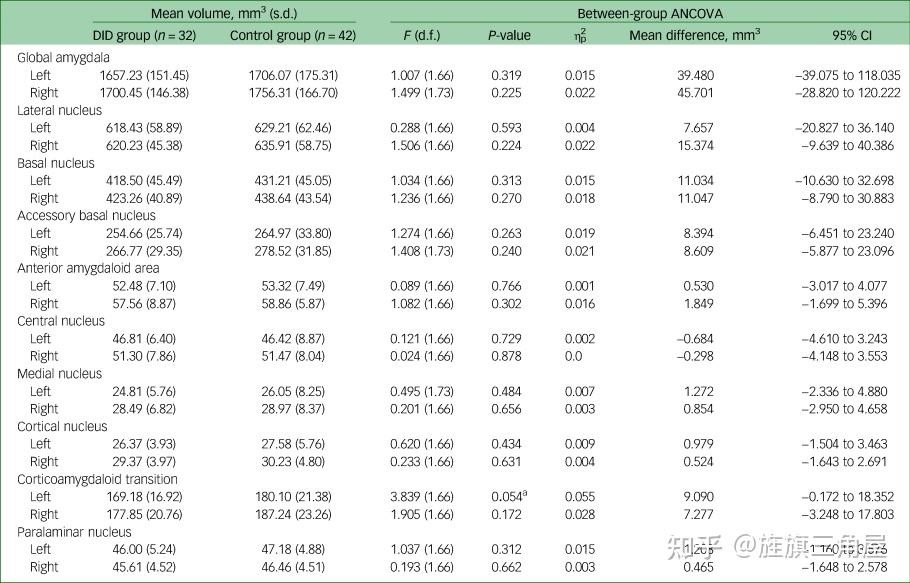
图表 1 :分离性身份识别障碍(DID)参与者与健康对照组杏仁核体积的描述性统计和协方差分析(ANCOVA)(ηp2,部分 eta 平方,a. 0.05 < P ≤ 0.1.)
研讨:
目前的研究证实了我们之前的发现,即DID患者的杏仁核体积正常。
虽然海马体对过量的压力荷尔蒙很敏感,这可能是它在患精神障碍时体积缩小的原因,但杏仁核的结构对压力荷尔蒙的敏感性可能比以前认为的要低。其中包括不同类型压力(如依恋缺失、身体虐待和情感忽视)的潜在影响、杏仁核结构对其激活频率和强度的敏感性以及对本体发育阶段的敏感性,以及前额叶对杏仁核激活的终生抑制。 (参考资料:Reinders, Willemsen, den Boer, Vos, Veltman and Loewenstein8,参考资料:Nijenhuis, Dorahy, Gold and O’Neil14 )。
最后,一种可能具有神经保护作用的效应在患妄想症的患者中可能更为明显,他们主要以一种或多种分离身份发挥作用,成功地避开情感暗示(emotion cues),这可能与前额叶频繁抑制杏仁核活动有关。这些未知因素都为未来的研究开辟了道路。
在我们的研究中,皮质-杏仁核过渡区的体积有缩小的趋势,这可能是由于三个中心的扫描仪不同造成的,参考 Morey 及其同事的研究,Morey、Clarke、Haswell、Phillips、Clausen 和 Mufford6 发现年龄和扫描仪这两个协变量对皮质-杏仁核过渡区有显著影响。尽管我们在所有三个中心都谨慎地使用了相同的扫描仪序列,并将中心作为一个协变量,但仍不能排除与皮质杏仁核过渡区的扫描仪差异有关的残差,这也可能是我们发现趋势的原因之一。
年龄是莫雷及其同事的研究中发现的第二个与杏仁核体积显著相关的协变量。在 DID 患者样本中,年龄对杏仁核体积的影响已被独立讨论。 参考 Vermetten、Schmahl、Lindner、Loewenstein 和 Bremner16。然而,在目前的研究中,年龄并不是导致杏仁核体积正常的污染因素,因为 DID 组和对照组是经过仔细匹配的(t(72) = -0.55, P = 0.581)。
Dimitrova、Dean、Schlumpf、Vissia、Nijenhuis 和 Chatzi2的这篇简短的报告是一系列脑成像论文的一部分,这些论文源自荷兰的两个中心和瑞士的一个中心之间的多中心合作。我们发现结构成像可以帮助诊断DID。
Reinders、Marquand、Schlumpf、Chalavi、Vissia和Nijenhuis10表示:没有证据表明DID是一种神经发育障碍。
Reinders、Chalavi、Schlumpf、Vissia、Nijenhuis和Jäncke9认为:海马亚区CA1可作为分离性遗忘症状的生物标志物。
Dimitrova、Dean、Schlumpf、Vissia、Nijenhuis 和 Chatzi2 的这些研究的结果均具有统计学意义,表明该数据集包含与 DID 诊断相关的强有力的形态学畸变,而且杏仁核体积正常是一个真实的发现。
因此,我们得出结论,我们之前报告的 DID 正常杏仁核容积(参考文献 Chalavi、Vissia、Giesen、Nijenhuis、Draijer 和 Barker3 )在提高统学计能力并研究了杏仁核各亚区对其整体容积的独立贡献后,仍能维持杏仁核容积正常的结论。
数据提供:
如有合理要求,可向通讯作者索取支持本研究结果的数据。
致谢:
我们感谢所有参与者及其治疗师。我们感谢 Nel Draijer 博士、Mechteld Giesen 博士、Ekaterina Weder 博士和 Eva Zimmermann 博士安排参与者的加入和扫描,以及对诊断访谈的评估和他们作为研究临床医生的支持。
作者贡献:
所有作者均已批准出版最终版本,并对工作的所有方面负责,确保与工作任何部分的准确性或完整性有关的问题得到适当的调查和解决。A.A.T.S.R.:构思、数据获取、资金获取、解释、方法学、项目管理、资源、监督、可视化、写作 – 评审和编辑。L.I.D.:正式分析、方法论、解释、软件、可视化、撰写原稿以及审阅和编辑。Y.R.S. 和 S.C.:数据采集、解释、方法、项目管理、软件、写作–审阅和编辑。E.M.V.:构思、数据采集、正式分析、解释、方法学、项目管理、撰写原稿及审查和编辑。E.R.S.N.和 L.J.:构思、数据采集、解释、方法论、写作–审阅和编辑。D.J.V.:构思、资金获取、正式分析、解释、监督、撰写–审阅和编辑。
资助
本文系独立研究成果,部分资金由国家健康研究院(NIHR)生物医学研究中心(位于南伦敦和莫兹利 NHS 基金会信托基金会)和伦敦国王学院提供。文中观点仅代表作者本人,与国家卫生服务机构、NIHR 或卫生部无关。A.A.T.S.R.得到了荷兰科学研究组织(www.nwo.nl)的资助,NWO-VENI资助号为451-07-009。S.C.获得了国际创伤与解离研究学会 (ISSTD) (http://www.isst-d.org/about/awards.htm) 的 David Caul 研究生研究基金的资助。Y.R.S. 得到了 Forschungskredit UZH 的资助。
利益声明:
D.J.V.和A.A.T.S.R.是《BJPsych Open》编辑委员会成员,未参与本文的审稿或决策过程。
脚注:
*共同第一作者。
引用列表:
1
Roydeva, MI, Reinders, AATS. Biomarkers of pathological dissociation: a systematic review. Neurosci Biobehav Rev 2021; 123: 120–202.CrossRefGoogle ScholarPubMed
2
Dimitrova, LI, Dean, SL, Schlumpf, YR, Vissia, EM, Nijenhuis, ERS, Chatzi, V, et al. A neurostructural biomarker of dissociative amnesia: a hippocampal study in dissociative identity disorder. Psychol Med [Epub ahead of print] 24 Jun 2021. Available from: https://doi.org/10.1017/S0033291721002154.CrossRefGoogle ScholarPubMed3
Chalavi, S, Vissia, EM, Giesen, ME, Nijenhuis, ERS, Draijer, N, Barker, GJ, et al. Similar cortical but not subcortical gray matter abnormalities in women with posttraumatic stress disorder with versus without dissociative identity disorder. Psychiatry Res Neuroimag 2015; 231: 308–19.CrossRefGoogle Scholar4
Nicholson, TR, Aybek, S, Kempton, MJ, Daly, EM, Murphy, DG, David, AS, et al. A structural MRI study of motor conversion disorder: evidence of reduction in thalamic volume. J Neurol Neurosurg Psychiatry 2014; 85: 227–9.CrossRefGoogle ScholarPubMed5
Spiegel, D, Lewis-Fernández, R, Lanius, R, Vermetten, E, Simeon, D, Friedman, M. Dissociative disorders in DSM-5. Annu Rev Clin Psychol 2013; 9: 299–326.CrossRefGoogle ScholarPubMed6
Morey, RA, Clarke, EK, Haswell, CC, Phillips, RD, Clausen, AN, Mufford, MS, et al. Amygdala nuclei volume and shape in military veterans with posttraumatic stress disorder. Biol Psychiatry Cogn Neurosci Neuroimag 2020; 5: 281–90.Google ScholarPubMed7
Lanius, RA, Vermetten, E, Loewenstein, RJ, Brand, B, Christian, S, Bremner, JD, et al. Emotion modulation in PTSD: clinical and neurobiological evidence for a dissociative subtype. Am J Psychiatry 2010; 167: 640–7.CrossRefGoogle ScholarPubMed8
Reinders, AATS, Willemsen, ATM, den Boer, JA, Vos, HPJ, Veltman, DJ, Loewenstein, RJ. Opposite brain emotion-regulation patterns in identity states of dissociative identity disorder: a PET study and neurobiological model. Psychiatry Res 2014; 223: 236–43.CrossRefGoogle ScholarPubMed9
Reinders, AATS, Chalavi, S, Schlumpf, YR, Vissia, EM, Nijenhuis, ERS, Jäncke, L, et al. Neurodevelopmental origins of abnormal cortical morphology in dissociative identity disorder. Acta Psychiatri Scand 2018; 137: 157–70.CrossRefGoogle ScholarPubMed10
Reinders, AATS, Marquand, AF, Schlumpf, YR, Chalavi, S, Vissia, EM, Nijenhuis, ERS, et al. Aiding the diagnosis of dissociative identity disorder: pattern recognition study of brain biomarkers. Br J Psychiatry 2019; 215: 536–44.CrossRefGoogle Scholar11
Chalavi, S, Simmons, A, Dijkstra, H, Barker, GJ, Reinders, AATS. Quantitative and qualitative assessment of structural magnetic resonance imaging data in a two-center study. BMC Med Imaging 2012; 12(1): 27.CrossRefGoogle Scholar12
Fischl, B. FreeSurfer. NeuroImage 2012; 62: 774–81.CrossRefGoogle ScholarPubMed13
Barry, TJ, Murray, L, Fearon, P, Moutsiana, C, Johnstone, T, Halligan, SL. Amygdala volume and hypothalamic-pituitary-adrenal axis reactivity to social stress. Psychoneuroendocrinology 2017; 85: 96.CrossRefGoogle ScholarPubMed14
Nijenhuis, E. Toward an ecology of dissociation in the context of trauma: Implications for the psychobiological study of dissociative disorders. In Dissociation and the Dissociative Disorders: Past, Present, Future (eds Dorahy, MJ, Gold, SN, O’Neil, J). Routledge, 2022.Google Scholar15
Spiegel, D. Reduced hippocampal and amygdalar volume in dissociative identity disorder: not such clear evidence. Am J Psychiatry 2006; 163: 2014.CrossRefGoogle ScholarPubMed16
Vermetten, E, Schmahl, C, Lindner, S, Loewenstein, RJ, Bremner, JD. Hippocampal and amygdalar volumes in dissociative identity disorder. Am J Psychiatry 2006; 163: 630–6.CrossRefGoogle ScholarPubMed
原文网址:Normal amygdala morphology in dissociative identity disorder | BJPsych Open | Cambridge Core
DOI: https://doi.org/10.1192/bjo.2022.36
发表信息:BJPsych Open , Volume 8 , Issue 2 , March 2022 , e70
